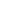Nyligen certifierade TÜV SÜD China Group (nedan kallad "TÜV SÜD") de elektroniska registren och elektroniska signaturerna i Haier Biomedicals system för hantering av flytande kväve i enlighet med kraven i FDA 21 CFR del 11. Sexton produktlösningar, oberoende utvecklade av Haier Biomedical, tilldelades TÜV SÜD:s efterlevnadsrapport, inklusive Smartand Biobank-serien.
Att erhålla FDA 21 CFR Part 11-certifiering innebär att de elektroniska registren och signaturerna i Haier Biomedicals LN₂-hanteringssystem uppfyller standarderna för trovärdighet, integritet, konfidentialitet och spårbarhet, vilket säkerställer datakvalitet och säkerhet. Detta kommer att påskynda införandet av lösningar för lagringssystem för flytande kväve på marknader som USA och Europa, vilket stöder Haier Biomedicals internationella expansion.
Efter att ha fått FDA-certifiering har HB:s system för hantering av flytande kväve påbörjat en ny internationaliseringsresa.
TÜV SÜD, en global ledare inom tredjepartstestning och certifiering, fokuserar konsekvent på att tillhandahålla professionellt stöd för efterlevnad inom olika branscher och hjälper företag att hålla sig uppdaterade om föränderliga regelverk. Standarden FDA 21 CFR Part 11, utfärdad av US Food and Drug Administration (FDA), ger elektroniska register samma rättsliga verkan som skriftliga register och signaturer, vilket säkerställer giltigheten och tillförlitligheten hos elektroniska data. Denna standard är tillämplig på organisationer som använder elektroniska register och signaturer inom biofarmaceutiska produkter, medicintekniska produkter och livsmedelsindustrier.
Sedan standarden lanserades har den antagits i stor utsträckning över hela världen, inte bara av amerikanska biofarmaceutiska företag, sjukhus, forskningsinstitutioner och laboratorier, utan även av Europa och Asien. För företag som förlitar sig på elektroniska register och signaturer är efterlevnad av kraven i FDA 21 CFR Part 11 avgörande för stabil internationell expansion, vilket säkerställer efterlevnad av FDA:s föreskrifter och relevanta hälso- och säkerhetsstandarder.
Haier Biomedicals CryoBio-system för hantering av flytande kväve är i huvudsak en "intelligent hjärna" för behållare med flytande kväve. Det omvandlar provresurser till dataresurser, där flera data övervakas, registreras och lagras i realtid, vilket varnar för eventuella avvikelser. Det har också oberoende dubbelmätning av temperatur och vätskenivåer, samt hierarkisk hantering av personaloperationer. Dessutom ger det visuell hantering av prover för snabb åtkomst. Användare kan växla mellan manuellt läge, gasfasläge och vätskefasläge med ett enda klick, vilket förbättrar effektiviteten. Dessutom integreras systemet med IoT- och BIMS-provinformationsplattformen, vilket möjliggör sömlös anslutning mellan personal, utrustning och prover. Detta ger en vetenskaplig, standardiserad, säker och effektiv lagringsupplevelse vid ultralåg temperatur.
Haier Biomedical har utvecklat en heltäckande lösning för lagring av flytande kväve, lämplig för alla scener och volymsegment, med fokus på de varierande kraven inom kryogen provlagring. Lösningen täcker olika scenarier, inklusive medicinska, laboratorie-, lågtemperaturlagrings-, biologiska serier och biologiska transportserier, och ger användarna en komplett processupplevelse inklusive teknisk design, provlagring, provhämtning, provtransport och provhantering.

Genom att följa FDA 21 CFR Part 11-standarderna har Haier Biomedicals CryoBio-system för hantering av flytande kväve certifierats för giltigheten av våra elektroniska signaturer och integriteten hos våra elektroniska register. Denna efterlevnadscertifiering har ytterligare stärkt Haier Biomedicals kärnkonkurrenskraft inom området för lagringslösningar för flytande kväve, vilket accelererar varumärkets expansion på globala marknader.
Accelerera internationell omvandling för att attrahera användare och förbättra konkurrenskraften på de globala marknaderna
Haier Biomedical har alltid följt en internationell strategi och kontinuerligt främjat ett dualt system med "nätverk + lokalisering". Samtidigt fortsätter vi att stärka utvecklingen av marknadssystem för att möta användarna och förbättrar våra scenarielösningar inom interaktion, anpassning och leverans.
Med fokus på att skapa den bästa användarupplevelsen stärker Haier Biomedical lokaliseringen genom att etablera lokala team och system för att snabbt kunna svara på användarnas behov. I slutet av 2023 hade Haier Biomedical ett utländskt distributionsnätverk med över 800 partners och samarbetat med fler än 500 leverantörer av eftermarknadstjänster. Samtidigt har vi etablerat ett system med erfarenhets- och utbildningscenter, centrerat kring Förenade Arabemiraten, Nigeria och Storbritannien, samt ett lager- och logistikcentersystem i Nederländerna och USA. Vi har fördjupat vår lokalisering i Storbritannien och replikerar gradvis denna modell globalt, vilket ständigt stärker vårt utländska marknadssystem.
Haier Biomedical accelererar också expansionen av nya produkter, inklusive laboratorieinstrument, förbrukningsvaror och smarta apotek, vilket ökar konkurrenskraften hos våra scenariolösningar. För användare inom life science har våra centrifuger gjort genombrott i Europa och Amerika, våra frystorkar har fått de första beställningarna i Asien och våra biosäkerhetsskåp har kommit in på den östeuropeiska marknaden. Samtidigt har våra laboratorieförbrukningsvaror uppnåtts och replikerats i Asien, Nordamerika och Europa. För medicinska institutioner utvecklas, förutom solcellsvaccinlösningar, även läkemedelskylskåp, blodförvaringsenheter och förbrukningsvaror snabbt. Genom kontinuerlig interaktion med internationella organisationer tillhandahåller Haier Biomedical tjänster inklusive laboratoriekonstruktion, miljötester och sterilisering, vilket skapar nya tillväxtmöjligheter.
I slutet av 2023 hade över 400 modeller av Haier Biomedical certifierats utomlands och framgångsrikt levererats till flera stora projekt i Zimbabwe, Demokratiska republiken Kongo, Etiopien och Liberia, samt till China-Africa Union Centers of Disease Control (CDC)-projektet, vilket visar på förbättringar i leveransprestandan. Våra produkter och lösningar har använts i stor utsträckning i över 150 länder och regioner. Samtidigt har vi upprätthållit ett långsiktigt samarbete med över 60 internationella organisationer, inklusive Världshälsoorganisationen (WHO) och UNICEF.
Att ha erhållit FDA 21 CFR Part 11-certifiering är en viktig milstolpe för Haier Biomedical då vi fokuserar på innovation i vår globala expansionsresa. Det visar också vårt engagemang för att möta användarnas behov genom innovation. Framöver kommer Haier Biomedical att fortsätta vår användarcentrerade innovationsstrategi och främja vår globala strategiska implementering över regioner, kanaler och produktkategorier. Genom att betona lokal innovation strävar vi efter att utforska de internationella marknaderna genom intelligens.
Publiceringstid: 15 juli 2024